Prebiótico Inulina/Oligofructosa en la raíz del
Yacón (Smallanthus sonchifolius), fitoquímica y estandarización como base de
estudios preclínicos y clínicos
Prebiotic Inulin/
Oligofructose in Yacón root (Smallanthus Sonchifolius), phytochemistry and
standardization as basis for clinical and pre-clinical research
Pedro P. Álvarez F1, 2, Bertha Jurado T3,
María Calixto C3, Nelly Incio V3, Jesús Silva A4.
1 Centro
Nacional de Salud Pública, Instituto Nacional de Salud (INS), Lima, Perú.
2 Laboratorio de Investigación en Plantas Medicinales, INS, Lima, Perú.
3 Laboratorio de Farmacognosia y Medicina Tradicional, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos.
4 Jardín Botánico, Centro Nacional de Salud Intercultural, INS, Lima, Perú.
2 Laboratorio de Investigación en Plantas Medicinales, INS, Lima, Perú.
3 Laboratorio de Farmacognosia y Medicina Tradicional, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos.
4 Jardín Botánico, Centro Nacional de Salud Intercultural, INS, Lima, Perú.
RESUMEN
INTRODUCCIÓN: Se
ha demostrado experimentalmente que la asociación inulina más oligofructosa
puede prevenir la colitis al modificar la microflora intestinal, actuando como
un prebiótico. También se ha encontrado que tal asociación de inulina más
oligofructuosa se encuentra en las raíces de Yacón (Smallanthus sonchifolius).
Ello, amerita su estudio fitoquímico como su estandarización, con el fin de
contribuir a su consumo con seguridad y calidad, a los ahorros en recursos de
salud y promover adicionales trabajos preclínicos y clínicos. El estudio se
realizó sobre la especie cultivada orgánicamente en la costa, adaptada de la
que crece en los Andes, para propiciar su consumo económico en sectores de la
sociedad que lo requieran.
OBJETIVOS: Determinar
la composición química general de las raíces tuberosas de Yacón cultivado en la
costa, mediante tamizaje fitoquímico. Además, la estandarización de su
Contenido de inulina para contribuir al conocimiento de las condiciones en su
empleo.
MÉTODOS: Con
las raíces cosechadas en el Jardín Botánico del Instituto Nacional de Salud en
Lima, se prepararon extractos acuosos por decocción y zumo para el tamizaje
Fitoquímico con reactivos convencionales. Se estandarizaron los extractos
acuosos por su contenido de inulina, empleando un estándar de fructuosa y
técnica analítica validada. Las muestras fueron leídas en un Espectrofotómetro
UV-VIS, Modelo TU-1810S Split Beam.
RESULTADOS: Los
ensayos confirmaron la presencia de compuestos fenólicos, flavonoides,
alcaloides, esteroides, glicósidos y carbohidratos. La estandarización encontró
valores de 7,8 % de inulina en el extracto hidrolizado y de 7, 01 % en el sin
hidrolizar.
CONCLUSIONES: Se
tamizaron y estandarizaron extractos de las raíces de Yacón, bajo condiciones
de cultivo conocidas. Se discuten las posibilidades de su empleo por su
propiedad prebiótica considerada de utilidad en ciertos tipos de colitis al
estimular el crecimiento de la microflora intestinal Lactobacillus y
Bifidobacterium, posibilitando Así los ahorros en recursos de salud, además de
motivar estudios preclínicos y clínicos Sobre el particular.
PALABRAS CLAVE: Prebiótico. Yacón. S. sonchifolius. Tamizaje.
Estandarización. Inulina. Lima.
ABSTRACT
INTRODUCTION: Experiments
have demonstrated that the association between inulin and oligofructose can
prevent colitis by modifying the intestinal microflora by acting as a
prebiotic. It has also been found that this association is naturally present in
the roots of the Yacón root (Smallanthus sonchifolius) making phytochemical and
standardization studies well worth pursuing. These studies could contribute to
the safe use of improved strains of Yacón, to significant savings in health
resources, and to promoting additional clinical and pre-clinical research. So
far, studies have been made on organically cultivated Yacón in the coast, on
varieties adapted from those cultivated in the Andes. The aim is to promote
consumption of Yacón in the sectors of society that need it most.
OBJECTIVE: To determine
the general chemical composition of the Yacón tuberous root cultivated in the
coast by means of a phytochemical screening, as well as standardizing its
inulin content in order to contribute knowledge on its conditions of use.
METHODS: The roots
harvested in the Lima Botanical Garden of the National Health Institute were used
to prepare aqueous extracts through decoction and juice for the phytochemical
screening with conventional reagents. The aqueous extracts were standardized
for inulin content by using a fructose standard method and a validated
analytical technique. The samples were read in a TU-1810S Split Beam UV-VIS
spectrophotometer.
RESULTS: The trials
confirmed the presence of phenolic compounds, flavonoids, alkaloids, steroids,
glycosides and carbohydrates. The standardization found values of 7,8% inulin
in the hydrolyzed extract and of 7, 01% in the non-hydrolyzed extract.
Conclusions: The extracts of the Yacón roots were screened and standardized
Ander known cultivation conditions. The possibilities of its use are being
considered due to its prebiotic properties. These properties are considered
useful in treating certain types of colitis by stimulating the growth of the
Lactobacillus and Bifidobacterium microflora. Saving of health resources would
be possible and further clinical and pre-clinical research would be encouraged.
KEYWORDS: Prebiotics,
Yacón, S. sonchifolius, Screening, Standardization, Inulin,
INTRODUCCIÓN
Se
ha demostrado experimentalmente, que la combinación prebiótica
inulina/oligofructosa es capaz de prevenir la colitis por producir cambios en
la microfl ora intestinal1. Por otro lado, es conocido que el Yacón (Smallanthus
sonchifolius (Poeppig & Endlicher) H. Robinson), es una planta con raíces
tuberosas de reserva, fusiformes, de sabor dulce principalmente por el
contenido de inulina/fructooligosacáridos (oligofructosa), aunque también
contiene proteínas, potasio, calcio y otras sustancias en cantidades pequeñas2.
Tales raíces han sido empleadas tradicionalmente por la población como alimento
y supuestas propiedades medicinales. Sin embargo, es relativamente nueva la
posibilidad de su empleo como prebiótico, lo cual podría significar una
alternativa con ahorros en recursos de salud para afecciones digestivas en las
cuales los prebióticos estén indicados.
El
Yacón es una planta de varias regiones de América, donde crece en las alturas
de los valles interandinos; aunque su cultivo se ha extendido a varios lugares
del mundo en altitudes menores. Inicialmente fue clasificado por Poeppig &
Endlicher como Polymnia sonchifolia. Sin embargo en 1978 H. Robinson
reestablece y lo incorpora al género Smallanthus, consagrando su nombre
botánico como Smallanthus sonchifolius3, especie de la familia Asteraceae.
Sus
raíces tuberosas son consumidas directamente crudas previamente lavadas y
peladas, o ralladas y coladas, o peladas y licuadas, aunque también
sometiéndolas a decocción o cocinando el zumo para convertirlas en dulces y
envasarlas, o sancochadas u horneadas, o aún deshidratadas para presentarlas
como harina. Pueden consumirse inmediatamente o después de varias semanas de la
cosecha, en este último caso las raíces tuberosas son depositadas en la sombra,
en caso contrario puestas al sol por algunos días. Asímismo, en refrigeración
para licuarlas obteniendo refrescos.
La
aceptación de la raíz tuberosa del Yacón se explica entre otras razones, porque
contiene inulina y fructooligosacáridos, que no son digeribles pero que
benefician al consumidor porque promueven una estimulación selectiva del
crecimiento y actividad de bacterias presentes en el colon, como son los
géneros Bifi dobacterium y Lactobacillus. La proliferación de esas bacterias
intestinales es conocida como efecto prebiótico4, por lo que en este sentido el
Yacón puede tener un valor comercial apreciado.
En
el Jardín Botánico del Instituto Nacional de Salud (INS) en Chorrillos, se
cultivó y cosechó el Yacón en un terreno de la costa casi a nivel del mar. El
objetivo del presente trabajo fue realizar ensayos de tamizaje fitoquímico y
explorar el contenido de inulina en extractos de las raíces tuberosas de tal
especie, cosechadas en el Jardín Botánico del INS bajo condiciones conocidas,
contribuyendo a su estandarización para su adecuado empleo con calidad y
seguridad, por su señalada propiedad prebiótica de favorecer el incremento de
la microflora intestinal útil para prevenir, superar o coadyuvar el tratamiento
de algunos tipos de colitis.
MATERIAL Y MÉTODOS
Fueron
ingresadas al Laboratorio de Investigación de Plantas Medicinales 10 kilogramos
de raíces tuberosas de Yacón cultivadas y cosechadas en el pequeño jardín
Botánico del INS localizado en el distrito de Chorrillos, adyacente al océano
pacífico y situado aproximadamente a 30 kilómetros de la ciudad de Lima. La
altitud del terreno es de 34 msnm. El clima es el mismo de la ciudad de Lima,
es decir templado, con máximas de 27°C en el verano y mínimas de 14°C en el invierno.
Las precipitaciones son escasas e inferiores a 16 mm al año para un promedio de
41 años (1950-1991).
Se
encuentra en zona de planicie e hidrográficamente pertenece a la cuenca del río
Rímac. Respecto al análisis del suelo, el pH (en pasta saturada) es 7.56,
contiene 61.15% de arena, 29.86% de limo, 8.99% de arcilla, siendo la textura
franco arenosa. El agua contiene calcio 5.04 meq/ L, magnesio 1.19 meq/L, sodio
1.38meq/L, potasio 0.20 meq/L, cloruro 2.00 meq/L, sulfato 2.40 meq/L,
bicarbonato 2.00 meq/L, nitratos 1.50 meq/L.
La
especie se cultivó de manera orgánica y solamente se empleó agua potable para el
riego, en una frecuencia tres veces a la semana durante el verano y dos veces a
la semana en invierno, no aplicándose pesticidas durante las fases del cultivo.
La siembra se realizó en el invierno, 3 de agosto del 2006, hasta su cosecha
que se realizó a fines del verano, Marzo del 2007. El ciclo vegetativo se
cumplió en alrededor de ocho meses. El tipo de cultivo fue en limpio, es decir
sin flora acompañante. Los tamaños de las plantas enteras alcanzaron 1,80
metros. El peso de las raíces por planta entera recolectada fue alrededor de
1,5 kilogramos. La cosecha se cumplió manualmente, al concluir el ciclo
vegetativo del cultivo.
El
peso de las raíces tuberosas, de color marrón y libre de objetos extraños, fue
variable, estando alrededor de los 300 gramos. Se encontraban libres de hongos,
picaduras e insectos. Al corte, su color interior fue blanco, o blanco con tono
ligeramente amarillo. Fueron puestos enteros en la sombra, sobre papel blanco
en una mesa con tablero de granito durante tres semanas en que comenzaron los
estudios fitoquímicos.
Para
el estudio, el lote recolectado fue separado en dos sublotes. Parte de ambos
sublotes fueron posteriormente colocados en refrigeración a 4º C para
emplearlos en caso necesario.
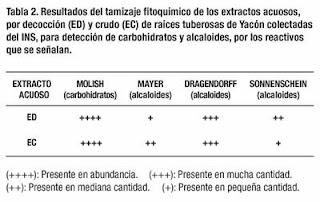
Tamizaje fitoquímico de los extractos acuosos
Una
vez subdividido en dos sublotes al azar, se practicó el tamizaje (screening)
fitoquímico correspondiente a dos tipos de extractos. Para ello, se peló
rápidamente un tubérculo representativo de cada sublote y de cada uno de ellos
se pesaron dos porciones de 20 gramos.
Una
de las porciones fue sometida a decocción en 100 mL de agua destilada por 60
minutos en baño maría a 70ºC. Con la otra porción se preparó el extracto crudo
(zumo), que fue obtenido por trituración en un mortero de porcelana.
Ambos
extractos fueron filtrados por separado y distribuidos en tubos de prueba de 10
mL a fin de realizar el tamizaje fitoquímico, cuyos resultados se encuentran en
la Tabla 2 y en la Tabla 3.
Estandarización de extractos
Fue
considerado parámetro el valor de la inulina cuantificada como azúcares
reductores. Se trabajó con extractos acuosos por decocción preparados con 160
gramos de raíz tuberosa de Yacón, conservado en medio ambiente, en 300 mL de
agua destilada por 90 minutos en baño maría a 70ºC. Luego de enfriar se
precipitó con etanol de 96º.
Para
la cuantificación de inulina, los extractos acuosos fueron ensayados como
extracto hidrolizado con HCl y extracto no hidrolizado. Los azúcares reductores
presentes en tales extractos fueron cuantificados usando el método de
Park-Johnson modificado por Hizukuri y col5, validado en un estudio previo por
M. Calixto6. Los resultados se encuentran en la Tabla 4.
Reactivos y procedimientos
Los
reactivos y estándar empleados fueron:
Reactivo a: Solución de cianuro de potasio (45 mM de carbonato de sodio, 109 mM de bicarbonato de sodio y 9,2 mM de cianuro de potasio).
Reactivo b: Solución de ferricianuro de potasio 1,5 mM
Reactivo c: Solución de sulfato férrico amoniacal (10,6 mM en ácido sulfúrico 50 mM).
Estándar de fructosa: 5 ug / mL, para la determinación de inulina.
Reactivo a: Solución de cianuro de potasio (45 mM de carbonato de sodio, 109 mM de bicarbonato de sodio y 9,2 mM de cianuro de potasio).
Reactivo b: Solución de ferricianuro de potasio 1,5 mM
Reactivo c: Solución de sulfato férrico amoniacal (10,6 mM en ácido sulfúrico 50 mM).
Estándar de fructosa: 5 ug / mL, para la determinación de inulina.
Las
muestras empleadas fueron:
Muestra 1: Muestra de extracto acuoso hidrolizado.
Muestra 2: Muestra de extracto acuoso no hidrolizado.
Las micropipetas empleadas tenían Certificados de calibración actualizados.
Muestra 1: Muestra de extracto acuoso hidrolizado.
Muestra 2: Muestra de extracto acuoso no hidrolizado.
Las micropipetas empleadas tenían Certificados de calibración actualizados.
El
procedimiento seguido se indica en la Tabla 1.
Las absorbancias a 715 nm fueron leídas en el Espectrofotómetro UV-VIS, Modelo TU-1810S Split Beam, del Laboratorio de Investigación de Plantas Medicinales del INS. El equipo contaba con Certificado de calibración actualizado. Los resultados se encuentran en la Tabla 4.
Las absorbancias a 715 nm fueron leídas en el Espectrofotómetro UV-VIS, Modelo TU-1810S Split Beam, del Laboratorio de Investigación de Plantas Medicinales del INS. El equipo contaba con Certificado de calibración actualizado. Los resultados se encuentran en la Tabla 4.
RESULTADOS
Tamizaje fitoquímico
Ambas
clases de extractos mostraron un perfil similar, aunque se encontraron pequeñas
diferencias no consideradas significativas, como se muestran en la Tabla 2 y en la Tabla 3.
Estandarización inicial de extractos
El
pH de los extractos acuosos por decocción fue 4,5. El contenido de inulina como
azúcares reductores (fructuosa) se expresa en la Tabla 4
DISCUSIÓN
Superando
el tiempo en el que estaba en camino a ser relegado al olvido, los estudios
acerca del Yacón respecto a su cultivo y empleo de la raiz tuberosa, en forma
tradicional y no tradicional, están siendo cada vez más frecuentes por sus
posiblidades como prebiótico a nivel del colon. Su capacidad de adaptación a
diversas ecologías, ha permitido su crecimiento en muchos lugares del mundo,
incrementando su importancia económica y sus posibilidades en ahorros de
recursos de salud. En el presente trabajo, con el fin de aportar a su empleo
adecuado, se procedió a avanzar en su estandarización, que implica su cuidado
desde el inicio del cultivo de esta especie de origen andino, que en este caso
se adaptó a las condiciones de la costa. Ello, que aún es original, tendría
algunas ventajas en el futuro respecto al ámbito económico, como la cercanía a
carreteras y puertos por donde saldría fácilmente al mercado nacional e
internacional, pero especialmente en nuestro medio por la presencia de
poblaciones numerosas de la costa para promover su consumo en aquellas que
tuvieran afecciones que requirieran del empleo de los prebióticos. Así mismo,
su adaptación en la costa no enfrentaría las heladas en los valles
interandinos, que de algún modo podría afectar su cultivo aunque la especie
suele ser resistente, debiendo estudiarse si en la costa también existe la gran
variabilidad ecológica señalada para la región andina7.
Su
consumo no otorga un significativo aporte calórico, por lo que la masa
ingerida, podría ser admitida como una opción para coadyuvar la terapia del
sobrepeso, lo cual debería ser convenientemente demostrado con ensayos clínicos
básicos.
Por
estudios experimentales realizados1, el consumo de las raíces de Yacón debería
considerarse como una alternativa particular en colitis en razón que la inulina
y los fructooligosacáridos, que constituyen sus principales componentes,
básicamente no son absorbidos por el tracto digestivo humano, por lo cual no
tendrían efecto sistémico por lo menos en lo que corresponde a la inulina, por
lo que su posible efecto benéfico estaría confinado localmente en la flora del
colon en el humano, donde promoverían el incremento de los géneros
Lactobacillus y Bifidobacterium. La capacidad de fermentar los
fructooligosacáridos de la raíces de Yacón ha sido demostrada4 para el
Lactobacillus acidophilus NRRL-1910, el Lactobacillus plantarum NRRL B-4496 y
el Bifidobacterium bifidum ATCC 15696, que son tres cepas probióticas
conocidas. La proliferación de esas bacterias intestinales es habitualmente
buscada por los consumidores y profesionales de la salud. Por otro lado, ha
sido demostrado en niños entre 1 a 2 años, en un ensayo clínico randomizado
controlado8, la efectividad de Lactobacillus acidophilus más Bifidobacterium
infantis, administrados vivos, en acortar significativamente la duración de la
diarrea aguda, lo que refuerza la idea de la utilidad de tales bacterias del
colon.
Además,
su empleo frecuente podría llevar a ciertos cambios favorables en la mucosa del
colon humano, si es que puede ser extrapolado el hallazgo experimental en
ratas, en las cuales al ser administradas con harina de Yacón con 5 a 7,5% de
fructooligosacáridos como suplemento dietético por 27 días, se produjo un
aumento en la profundidad y número de criptas del colon9. Dicho hallazgo podría
estar relacionado, de ocurrir en el humano, con una mayor absorción de
minerales por el incremento de la superficie de absorción.
En
otro sentido, su ingesta en ratas normales como suplemento dietario en forma de
harina de raiz durante cuatro meses, fue bien tolerado y no produjo toxicidad,
no demostrando actividad hipoglicémica10. No se ha encontrado algún ensayo
clínico controlado con placebo que demuestre actividad hipoglicémica por la
ingesta de la raíz del Yacón.
Los
resultados del tamizaje fitoquímico permitieron confirmar alcaloides,
carbohidratos, flavonoides, glicósidos, fenólicos y esteroides. Se prefirió
trabajar en dos extractos, uno muy común que corresponde al zumo de las raíces
y que puede ser considerado como el de empleo tradicional, en tanto que el otro
extracto corresponde a la decocción y estaría más en relación con el empleo
moderno de utilizar extractos acuosos. Nos llamó la atención la posible
presencia de esteroides, que podría ameritar un estudio adicional. En efecto,
en algunas plantas se han encontrado hormonas esteroides, denominadas
esteroides vegetales brassinoesteroides que actúan sobre receptores esteroides
de membrana conocidos como BRI1, que regulan el crecimiento y desarrollo de las
plantas11,12 por mecanismos aún en investigación. Hasta donde se ha buscado, no
hay descripción de esteroides encontrados en extractos de Yacón, aunque de
haberlos podría corresponder al mecanismo natural descrito.
Respecto
a la estandarización de extractos, se prefirieron los obtenidos por decocción,
en razón de los resultados alcanzados en el tamizaje fitoquímico. La diferencia
entre el hidrolizado y el extracto sin hidrolizar permitieron apreciar un
contenido similar de inulina, algo mayor en el hidrolizado. En los resultados
del contenido de inulina, similar a lo encontrado en otro estudio13, debe
considerarse que podría haber declinado alguna cantidad durante el tiempo de
depósito de las raíces, debido a la actividad metabólica intrínseca por su
dependencia enzimática, para convertirse en azúcares simples (sacarosa,
fructosa, glucosa). Además, las cantidades de inulina en las raíces podría en
alguna forma relacionarse con la calidad del suelo y las condiciones
ambientales, habiéndose descrito la variabilidad química y biológica de la
especie cultivada bajo condiciones de campo, expresadas en el peso y contenido
de oligofructanos14.
Una
depolimerización inicial15 que ha sido descrita para los días subsecuentes de
la cosecha, podría haber intervenido también en los niveles de inulina
encontrados. Las diferencias en el contenido de enzimas de fructanos de
diversas especies de Asteraceae16 han permitido entender el metabolismo de
tales fructanos y sus diferentes grados de polimerización, que no son similares
entre esas especies. No parecen existir evidencias que las cantidades
diferentes de inulina y fructooligosacáridos en las raíces pudieran alterar sus
propiedades prebióticas a nivel del colon, ni en su posible empleo en dietas
para el sobrepeso, considerando su escasa o nula absorción y consecuente
ausencia de efectos sistémicos.
Los
ensayos preclínicos y clínicos, para cualquier posibilidad terapéutica en
plantas medicinales, incluso el monitoreo en su empleo común incluso para
descartar la presencia de biotoxinas17, requieren un apoyo económico que no
siempre es asumido por un patrocinador relacionado a productos naturales. En
países en vías de desarrollo, entre el 70 a 80% de la población utiliza como
recurso para su cuidado primario de salud, las plantas medicinales18. Por ello,
la participación del Estado es fundamental a través de políticas de
investigación en instituciones con presupuesto para ello, a fin de promover y
apoyar los laboratorios y acciones de investigación en plantas medicinales.
En
conclusión, se ha contribuído a reafirmar la composición química general de las
raíces tuberosas del Yacón (Smallanthus sonchifolius), la estandarización
inicial de tales raíces, con la ventaja de estar cultivada bajo condiciones
agronómicas conocidas en una zona de costa, determinando la cantidad de inulina
mediante una técnica sencilla. Ello contribuiría a promover su utilidad
prebiótica con ahorros en recursos de salud, para diversos sectores de
población con diversos tipos de colitis, a fin de prevenirla, superarla o
coadyuvar en su tratamiento al incrementar los Lactobacillus y Bifidobacterium
considerados microflora útiles a nivel intestinal. De otro lado, como la
inulina no se absorbe por vía oral, motivará estudios preclínicos y clínicos
para confirmar la posibilidad terapéutica de las raíces en las dietas para el
sobrepeso.
BIBLIOGRAFÍA
1. HOENTJEN F, WELLING GW,
HARMSEN HJM, et al. The prebiotic combination inulin/ oligofructose prevents
colitis in HLA-B27 transgenic rats associated with immunomodulation and changes
in intestinal microfl ora. Can J Gastroenterol 2005 ; 19 Suppl B: 9B.
2. TAKENAKA M, YAN X, ONO
H, et al. Caffeic acid derivatives in the roots of yacón (Smallanthus
sonchifolius). J Agric Food Chem 2003; 51(3):793-6.
3. VALENTOVÁ K, ULRICHOVÁ
J. Smallanthus sonchifolius and Lepidium meyenii – prospective andean crops for
the prevention of chronic diseases. Biomed Papers 2003; 147(2): 119–130.
4. PEDRESCHI R, CAMPOS D,
NORATTO G, et al. Andean Yacón root (Smallanthus sonchifolius Poepp. Endl)
fructooligosaccharides as a potential novel source of prebiotics. J Agric Food
Chem 2003; 51(18): 5278-84.
5. HIZUKURI S, TAKEDA Y,
YASUDA M. Multi-branched nature of Amylose and the action of debranching
enzymes. Carbohydrate Research 1981; 94: 205-13.
6.
CALIXTO COTOS, MARIA R. Extracción y modifi cación enzimatica del almidón de
Amaranthus caudatus. [Tesis para optar el Grado de Magister en Bioquímica].
Lima, Facultad de Medicna de la Universidad Nacional Mayor de San Marcos; 2002.
7.
MANSILLA RC, LÓPEZ C, BLAS R, et al. Análisis de la variabilidad molecular de
una colección peruana de Smallanthus sonchifolius (Poepp & Endel) H.
Robinson “Yacón”. Ecología Aplicada
2006; 5(1,2): 75-80.
8. VIVATVAKIN B,
KOVITDAMRONG A. Randomized controlled trial of live Lactobacillus acidophilus
plus Bifi dobacterium infantis in treatment of infantile acute watery diarrhea.
Can J Gastroenterol 2005 ; 19 Suppl B: 9B.
9. LOBO AR, COLLI C,
ALVARES EP, et al. Effects of fructans-containing yacón (Smallanthus sonchifolius
Poepp and Endl.) fl our on caecum mucosal morphometry, calcium and magnesium
balance, and bone calcium retention in growing rats. Br J Nutr 2007; 97(4): 776-85.
10.
GENTA SB, CABRERA WM, GRAU A, et al. Subchronic 4-month oral toxicity study of dried
Smallanthus sonchifolius (yacón) roots as a diet supplement in rats. Food Chem
Toxicol 2005; 43(11): 1657-65.
11. YIN Y, VAFEADOS D, TAO
Y, et al. A New Class of Transcription Factors Mediates Brassinosteroid-
Regulated Gene Expression in Arabidopsis. Cell 2005; 120 (2): 249-259.
12. VERT G & CHORY J.
Downstream nuclear events in brassinosteroid signalling. Nature 2006; 441:
96-100.
13. NARAI-KANAYAMA A,
TOKITA N, ASO K. Dependence of Fructooligosaccharide Content on Activity of
Fructooligosaccharide-Metabolizing Enzymes in Yacón (Smallanthus sonchifolius)
Tuberous Roots during Storage. Journal of Food
Science 2007; 72 (6): S381–S387.
14.
VALENTOVA K, LEBEDA A, DOLEZALOVA I, et al. The biological and chemical
variability of yacón. J Agric Food Chem 2006; 54(4): 1347-52.
15. GRAEFE S, HERMANN M,
MANRIQUE I, et al. Effects of post-harvest treatments on the carbohydrate
composition of yacón roots in the Peruvian Andes. Field Crops Research 2004;
86: 157–65.
16. ITAYA NM, ASEGA AF,
CARVALHO MAM, et al. Hydrolase and fructosyltransferase activities implicated
in the accumulation of different chain size fructans in three Asteraceae
species. Plant Physiology and Biochemistry 2007;
45(9): 647-56.
17.
ALVAREZ PP, SANTIAGO CA. Ausencia de biotoxina acido domoico en los Pantanos de
Villa Chorrillos, Perú. Ecología Aplicada 2006; 5(1,2): 167-70.
18.
WANDA GJ, NJAMEN D, YANKEP E, et al. Estrogenic properties of isoflavones derived from
Millettia griffoniana. Phytomedicine 2006; 13(3): 139-45